|
|
|
|
Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Download Reaktionen Spiele Gadgets Kontakt <<< Elektrolyse Galvanische Zelle >>> NormalpotentialEdel oder nicht edelWiederholen wir das Experiment des vorherigen Kapitels mit normalem Kochsalz (Natriumchlorid, NaCl) anstelle von Kupferchlorid. Während des Elektrolyseprozesses wurden die ionischen Bestandteile des Kupferchlorids (CuCl2) in ihre elementaren Formen überführt. An der Kathode konnte die Abscheidung von elementarem Kupfer beobachtet werden und an der Anode stieg gasförmiges Chlor auf. Wir erwarten also, dass sich nun elementares Natrium anstelle des Kupfers an der Kathode abscheidet und an der Anode wiederum Chlorgas entsteht. Wenn wir das Experiment starten, sehen wir jedoch an beiden Elektroden Gasblasen aus dem Elektrolyten aufsteigen! Wie erwartet, entsteht Chlorgas an der Anode. Das an der Kathode aufsteigende Gas ist Wasserstoff. Warum finden wir kein elementares Natrium an der Kathode? Nun, elementares Natrium reagiert stark mit Wasser und wenn man ein kleines Stück davon in einen Behälter mit Wasser gibt, springt dieses im Ablauf der exothermen Reaktion auf der Wasseroberfläche wild umher. Die Reaktion von Natrium mit Wassermolekülen ergibt Natriumhydroxid und Wasserstoffgas:Geben wir hingegen ein Stück Kupfer in Wasser, so passiert nichts. Als wir im Kapitel zu chemischen Reaktionen über die Eigenschaften von Stoffen gesprochen haben, war ein Punkt die Korrosionsbeständigkeit, was der Reaktivität mit Wasser und Sauerstoff entspricht. Ich vermute einmal, dass ihr bereits wisst, dass Platin, Gold und Kupfer nicht mit Wasser und Sauerstoff reagieren und sich dabei auflösen. Diese Metalle nennt man Edelmetalle. Auf der anderen Seite korrodieren unedle Metalle wie Natrium oder Eisen, wenn sie Wasser und Sauerstoff ausgesetzt werden. Wie edel ein Metall ist, kann durch die chemische Reaktion zwischen einem elementaren Metall und den Ionen eines anderen Metalls herausgefunden werden. Wenn wir einen Eisennagel in eine Lösung von Kupferchlorid geben, ändert dieses schnell seine Farbe, sobald sich metallisches Kupfer auf seiner Oberfläche abscheidet, während gleichzeitig elementares Eisen in Eisenchlorid verwandelt wird. Die Reaktionsgleichung ist gegeben durch: Verwendet man elementares Kupfer und Silberchlorid, so wird das Kupfer langsam (Silbernitrat ist nur schwer löslich in Wasser) nach der folgenden Reaktionsgleichung mit elementarem Silber überzogen: Nichts passiert hingegen, wenn ein Stück Kupfer zu einer Lösung von Eisenchlorid oder Silber zu Kupferchlorid gegeben wird. Diese kleine Reaktionsreihe erlaubt uns eine Einordnung der Metalle von Edel (Silber) nach unedel (Eisen), mit Kupfer dazwischen, durchzuführen. Dissoziation von WasserDie chemischen Elemente der ersten (Haupt)gruppe des Periodensystems tendieren dazu, ionische Bindungen zu bilden, indem sie ihr einziges Valenzelektron an ein anderes Element mit einer höheren Elektronegativität abgeben. Damit sind diese Elemente bestrebt, einfach geladene Kationen zu bilden. Die einzige Ausnahme dieser Regel bildet Wasserstoff, da dessen Valenzelektron gleichzeitig das einzige Elektron des ganzen Atoms ist. Würde Wasserstoff dieses Elektron abgeben, so existierte das Restatom ohne Elektronenhülle! Das ist der Grund, warum Wasserstoff keine kristallinen, ionischen Salze bildet, wenn es mit einem Element der 17. Gruppe (Halogene) reagiert, was alle anderen Elemente der ersten Gruppe (Alkalimetalle) machen. Die Reaktion von Wasserstoff und Chlorgas ergibt Chlorwasserstoff, welches ein farbloses Gas ist. Ein Wasserstoffatom bildet dabei eine kovalente Bindung mit einem Chloratom aus, wodurch ein zweiatomiges Molekül entsteht.Wie bereits im vorherigen Kapitel erwähnt, wird ein elektrischer Strom durch eine wässrige Lösung durch das Fließen von Ionen gebildet, wodurch die Leitfähigkeit eines Elektrolyten mit der Anzahl der darin befindlichen Ionen steigt. Die Leitfähigkeit von reinem Wasser ist sehr niedrig, aber sie steigt spürbar, sobald Chlorwasserstoffgas in Kontakt mit dem Wasser gerät. Es sieht ganz so aus, als ob Chlorwasserstoff in Ionen dissoziiert und dabei "Wasserstoff-Kationen", sowie Chlorid-Anionen entstehen würden. Das passiert tatsächlich - aber: Die "Wasserstoff-Kationen", die sich in wässriger Lösung bilden, bestehen nicht aus einem einzigen Proton. In einem Prozess, der als Protonierung von Wasser bezeichnet wird, bilden sich Hydroniumionen (auch als Oxonium oder Oxidanium bezeichnet): 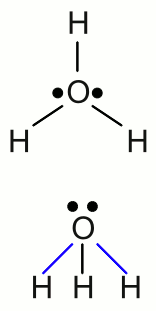 Struktur des Hydroniumions:
Struktur des Hydroniumions:Das einfach geladene H3O+ Kation besteht aus einem Sauerstoffatom, das drei kovalente Bindungen mit drei Wasserstoffatomen ausbildet. Die Geometrie ähnelt einem Tetraeder mit dem Sauerstoffatom an der oberen Spitze und einem Winkel von circa 113 Grad zwischen den kovalenten Bindungselektronen. Aufgrund dieser Geometrie besitzt das Ion ein Dipolmoment mit der negativen Ladung nahe an dem Sauerstoffatom. Die obere Zeichnung zeigt das Molekül von oben, die untere Zeichnung von einer Seite, wobei die blau markierten Bindungen nach vorne und die schwarze Bindung nach hinten zeigt. Die Leitfähigkeit von reinem Wasser ist sehr gering, aber nicht gleich Null, was auf die Anwesenheit von Ionen schließen lässt. Wasser kann sich in Hydroniumionen und Hydroxidionen aufspalten, wobei die folgende Reaktionsgleichung gilt: 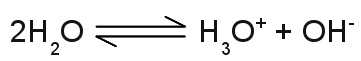
Die Zahl der Hydroniumionen in einer wässrigen Lösung wird durch den p[H]-Wert angegeben. Dieser ist definiert als der negative dekadische Logarithmus der Hydroniumionen (H3O+). Ein kleiner p[H]-Wert steht für eine hohe Konzentration an Hydroniumionen, ein hoher p[H]-Wert für eine niedrige Konzentration.. Heute wird die Definition des pH-Wertes verwendet, die sich leicht unterscheidet: Der pH-Wert bezeichnet den negativen dekadischen Logarithmus (= Zehnerlogarithmus) der Wasserstoffionen-Aktivität. Die Werte der pH-Skala reichen von 0 bis 14 mit dem Mittelwert 7, der dem pH-Wert von reinem Wasser entspricht (die Anzahl der Hydroniumionen ist gleich der Anzahl der Hydroxidionen). Der pH-Wert ist kleiner als 7, wenn ein Überschluss an Hydroniumionen vorhanden ist (Diese Lösungen nennt man sauer) und höher als 7, wenn ein Überschuss an Hydroxidionen vorhanden ist (diese Lösungen nennt man basisch oder alkalisch). Säuren sind Substanzen, die in wässriger Lösung Hydroniumionen bilden, Laugen (Basen) sind Substanzen, die in wässriger Lösung Hydroxidionen bilden. NormalpotentialFür die Durchführung einer Elektrolyse, sollte man geeignetes Material für die Elektroden verwenden. Wie bereits oben erwähnt, sind Elektroden aus Eisen ungeeignet, besonders bei einer Elektrolyse mit Kupferchlorid. Die Korrosion der Eisenelektroden würde starten, sobald diese in Kontakt mit der wässrigen Lösung treten. Wird Kupferchlorid als Elektrolyt verwendet, sollten die Elektroden aus Kupfer oder einem noch edleren Metall bestehen, wie Silber, Gold, Platin oder Graphit. Interessant ist eine Anordnung mit zwei unterschiedlichen Metallen als Elektroden, wie zum Beispiel Kupfer und Eisen. Dabei kann eine Spannung an den Elektroden gemessen werden, obwohl diese an keine Spannungsquelle angeschlossen sind! Eine derartige Anordnung ist eine Art Batterie. Der Wert der gemessenen Spannung zwischen den Elektroden wird dabei hauptsächlich von der Materialpaarung der Elektroden, dem verwendeten Elektrolyten und dessen Konzentration bestimmt. Eine sehr spezielle Elektrode ist die Standard Wasserstoff Elektrode (kurz SHE von der englischen Bezeichnung "standard hydrogen electrode"). Die SHE bildet die Basis für den Vergleich mit anderen Materialien. Die Standard Wasserstoff Elektrode besteht aus einer in Säure eingetauchten Platinelektrode, an der Wasserstoffgas entlang geleitet wird. Der Versuchsaufbau basiert auf der chemischen Reaktion: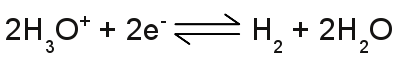
Elektrochemische SpannungsreiheDie folgende Tabelle listet die Potentialdifferenzen verschiedener Materialien zur SHE auf und stammt aus der Wikipedia:
BemerkungenWie edel ein Metall ist, kann an der Tabelle abgelesen werden. Edler Metalle sind oberhalb unedlerer Metalle angeordnet.Wenn eine Metallplatte in Kontakt mit einer wässrigen Lösung aus Ionen eines edleren Metalles gerät, wird die Metallplatte aufgelöst, während sich das edlere Metall an deren Oberfläche abscheidet. Hydronium Kationen können als Metallionen aufgefasst werden. Wenn Wasser in Kontakt mit einem unedleren Metall gerät, tritt Korrosion auf und Wasserstoffgas entsteht. In einer Lösung verschiedener Metallionen scheidet sich das Metall mit der höchsten (positiven) Spannung als erstes ab. Daher entsteht Wasserstoffgas an der Kathode, wenn Natriumchlorid als Elektrolyt durch Elektrolyse zersetzt wird. <<< Elektrolyse Galvanische Zelle >>> Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Archiv Download Reaktionen Spiele Verweise Gadgets Kontakt Impressum |
|
|