|
|
|
|
Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Download Reaktionen Spiele Gadgets Kontakt <<< Normalpotential Korrosion >>> Galvanische ZelleHalbzelleEine Versuchsanordnung bestehend aus einer Metallelektrode, die in eine wässrige Lösung ihres Metallsalzes getaucht ist, wird als Halbzelle bezeichnet. Ein Beispiel für eine derartige Halbzelle ist eine Kupferelektrode, die in eine wässrige Lösung aus Kupferchlorid getaucht ist. Sobald die Elektrode in die Lösung eintaucht, läuft folgende Reaktion ab:Kupferatome gehen als positiv geladene Cu2+ Kationen in den Elektrolyten über, wobei jedes Atom zwei Elektronen in der Elektrode zurück lässt. Als Ergebnis dieser Reaktion wird die Elektrode negativ aufgeladen: 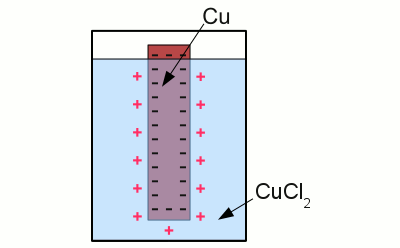
Kupfer in einer wässrigen Lösung aus Kupferchlorid: Die überzähligen Elektronen innerhalb der Elektrode ordnen sich derart an, dass das elektrische Feld innerhalb des elektrisch leitenden Materials Null ergibt. Als Ergebnis dieses Bestrebens stoppen die Elektronen ihre Bewegung an der Oberfläche der Elektrode. Eine Lage positiv geladener Kupferionen wird durch die Coulombkraft von der Oberfläche der Elektrode angezogen, was weitere Kupferatome daran hindert, als Ionen in Lösung zu gehen. Der Zustand chemischen Gleichgewichts ist erreicht. Die Anzahl der Kupferatome, die als Ionen in Lösung gehen, gleicht der Anzahl der Ionen, die als Kupferatome auf der Elektrode abgeschieden werden. Der Potentialunterschied zwischen der positiven Ladung des Elektrolyten und der negativen Ladung der Elektrode im Gleichgewichtszustand hängt im wesentlichen von der verwendeten Kombination aus Metall und Metallsalz ab. Die Tendenz, in einer wässrigen Lösung als Ionen in Lösung zu gehen, unterscheidet sich von Metall zu Metall. Diese Eigenschaft wird als Lösungstension bezeichnet. Je edler das Metall, desto geringer die Tendenz in Lösung zu gehen. Galvanische ZelleEine Anordnung bestehend aus zwei Halbzellen, die über eine Salzbrücke miteinander verbunden sind, bezeichnet man als Galvanische Zelle. Jede Halbzelle besteht aus einem Metall und der Lösung seines Metallsalzes: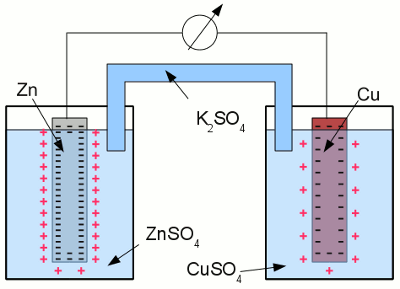
Galvanische Zelle: Die linke Halbzelle besteht aus einer Zinkelektrode und einer Lösung von Zinksulfat, die rechte Halbzelle aus einer Kupferelektrode in einer Lösung aus Kupfersulfat. Kupfer ist edler als Zink, sodass die Anzahl der Zinkatome, welche in der linken Halbzelle als Ionen in Lösung gehen, höher ist als die Anzahl der in Lösung gehenden Kupferatome in der rechten Halbzelle. Die chemischen Reaktionen in den beiden Halbzellen sind gegeben durch: 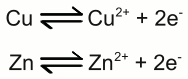
Zwischen beiden Elektroden der Halbzellen kann eine Spannungsdifferenz gemessen werden. Werden die beiden Elektroden durch einen Draht verbunden, beginnen Elektronen aufgrund dieser Spannungsdifferenz von der Zinkelektrode zur Kupferelektrode zu fließen. Eine geringere Anzahl an Elektronen innerhalb der Zinkelektrode führt zu einer geringeren Anzahl an Zinkionen, die an die Oberfläche der Elektrode über die Coulombkraft gebunden sind. Als Konsequenz davon, können weitere Zinkatome als Ionen in Lösung gehen. Umgekehrt führt eine größere Anzahl an Elektronen in der Kupferelektrode dazu, dass mehr Kupferionen von der Kupferelektrode angezogen werden, womit Kupferionen als Kupferatome an der Oberfläche der Elektrode abgeschieden werden. Der Elektrolyt der rechten Halbzelle wird damit negativ geladen, der der linken Halbzelle positiv. Daher wird eine Salzbrücke benötigt, um den Stromfluss aufrecht zu erhalten. Sulfat-Anionen können über diese von der rechten in die linke Halbzelle fließen, um die Ladungsdifferenz auszugleichen. 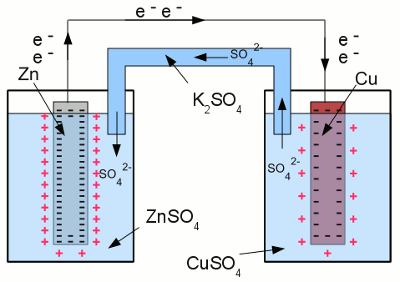
Kurzgeschlossene galvanische Halbzellen: Angetrieben von der Spannungsdifferenz zwischen den Elektroden der beiden Halbzellen, fließen Elektronen von der Zink- zur Kupferelektrode. Um die Ladungsdifferenz zwischen den beiden Halbzellen auszugleichen, fließen zweifach negativ geladene Sulfationen über die Salzbrücke von der rechten in die linke Halbzelle. Die chemische Reaktion endet erst, wenn entweder die Zinkelektrode komplett zu Zinksulfat oxidiert worden ist, oder alle Kupferionen zu elementarem Kupfer reduziert worden sind. Das edlere Metall oxidiert das unedlere in einer Redoxreaktion: Die Spannungsdifferenz einer galvanischen Zelle ergibt sich als Differenz der Potentiale der Halbzellen, die in der Tabelle der Normalpotentiale abgelesen werden kann. In obigem Beispiel ergibt die Halbreaktion von Cu und Cu2+ +0,35V und die Halbreaktion zwischen Zn und Zn2+ -0,76V. Werden beide Werte voneinander subtrahiert, ergibt sich ein Wert von: <<< Normalpotential Korrosion >>> Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Archiv Download Reaktionen Spiele Verweise Gadgets Kontakt Impressum |
|
|