|
|
|
|
Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Download Reaktionen Spiele Gadgets Kontakt <<< Reaktionsgleichungen Elektrolyse >>> RedoxreaktionOxidationDer französische Chemiker Antoine Laurent de Lavoisier führte als erster den Begriff der Oxidation ein, um chemische Verbindungen zu beschreiben, die das Element Sauerstoff enthalten. Er demonstrierte ferner die Rolle von Sauerstoff beim Rosten von Metallen und zeigte, dass Atmung im Prinzip eine sehr langsam ablaufende Verbrennung organischen Materials durch eingeatmeten Sauerstoff ist.Etwas später wurde der Begriff der Oxidation um Reaktionen erweitert, bei denen Molekülen Wasserstoff entzogen wird. Ausgehend von neueren Modellen zur Elektronenhülle von Atomen wurde der Begriff weiter verallgemeinert. Heutzutage wird Oxidation als die Abgabe von Elektronen oder die Erhöhung der Oxidationszahl eines Atoms, Moleküls oder Ions bezeichnet. OxidationszahlDie Oxidationszahl, auch Oxidationsstufe, Oxidationswert oder elektrochemische Wertigkeit genannt, gibt an, wie viele Elektronen ein Atoms in einer Verbindung aufgenommen beziehungsweise abgegeben hat. Um den Oxidationsgrad eines Atoms zu bestimmen, werden folgende Regeln angewendet:1.) Die Oxidationszahl eines Atoms im elementaren Zustand ist immer Null. 2.) Die Oxidationszahl eines einatomigen Ions entspricht der Ladung des Ions. Natriumchlorid ist zum Beispiel eine Substanz mit der chemischen Formel NaCl. Die Oxidationszahl des einfach positiv geladenen Natriumions ist +1, die des einfach negativ geladenen Chlorions ist -1. Das zweifach positive Magnesium-Kation von Magnesiumchlorid (MgCl2) besitzt die Oxidationsstufe +2, während die beiden einfach negativ geladenen Chlorionen die Oxidationsstufe -1 besitzen. 3.) Die Elektronenpaare kovalenter Bindungen zwischen zwei Atomen werden dem Bindungspartner mit der höheren Elektronegativität zugeordnet. Damit werden formale Ionen geschaffen, deren Oxidationszahl durch Regel Nummer 2 bestimmt wird (die Oxidationszahl ist gleich der formalen Ladung oder Formalladung). Wenden wir Regel Nummer 3 an einigen Beispielen an: 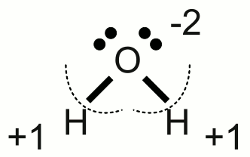 Wassermolekül:
Wassermolekül:Ein Wassermolekül besteht aus einem Sauerstoffatom, das über kovalente Bindungen an zwei Wasserstoffatome gebunden ist. Die Elektronegativität von Sauerstoff ist höher als die von Wasserstoff (was in der PSE Tabelle abgelesen werden kann), womit die bindenden Elektronenpaare dem Sauerstoffatom zugeordnet werden. Damit besitzt dieses (virtuell) acht Valenzelektronen anstelle der sechs Valenzelektronen des elementaren Sauerstoffs und das so entstandene (virtuelle) Sauerstoffion ist zweifach negativ geladen. Die Oxidationszahl des Sauerstoffatoms im Wassermolekül ist somit -2. Jedes der Wasserstoffatome hat (virtuell) sein Valenzelektron abgegeben und bildet nun ein einfach positiv geladenes Kation, womit sich die Oxidationszahl der Wasserstoffatome im Wassermolekül zu +1 ergibt. 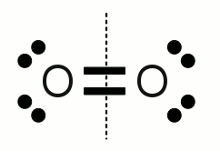 Sauerstoffmolekül:
Sauerstoffmolekül:Ein Sauerstoffmolekül besteht aus zwei über eine Doppelbindung verbundenen Sauerstoffatomen. Die Elektronegativität beider Atome ist gleich, weshalb die bindenden Elektronenpaare zu gleichen Teilen auf die beiden Atome aufgeteilt werden. Damit erhält jedes Sauerstoffatom sechs Valenzelektronen, was der Anzahl der Elektronen in einem einzigen, neutralen Sauerstoffatom entspricht. Die Oxidationszahl ist somit 0, was eine Bestätigung von Regel Nummer 1 ist. 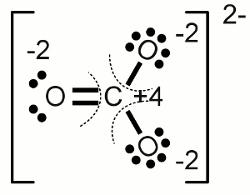 Carbonat-Anion:
Carbonat-Anion:Die Elektronegativität von Sauerstoff ist höher als die von Kohlenstoff, womit die Elektronen der kovalenten Bindungen jeweils dem Sauerstoffatom zugeordnet werden. Eines der drei Sauerstoffatome bildet eine Doppelbindung mit dem Kohlenstoffatom, die beiden anderen jeweils eine Einfachbindung. Eine weitere Eigenschaft des Carbonations ist die Tatsache, dass dieses zweifach negativ geladen ist. Die beiden überzähligen Elektronen werden den einfach gebundenen Sauerstoffatomen zugeordnet. Als Ergebnis erhalten wir damit eine Oxidationszahl von -2 für alle drei Sauerstoffatome und +4 für das Kohlenstoffatom, das alle Valenzelektronen "abgegeben" hat. Die Summe der Oxidationszahlen ergibt -2 ReduktionDer Prozess der Reduktion ist der Umkehrprozess der Oxidation, also die Aufnahme von Elektronen beziehungsweise die Verringerung der Oxidationszahl.RedoxreaktionWenn im Verlauf einer chemischen Reaktion ein oder mehrere Atome oxidiert werden, müssen gleichzeitig andere Atome reduziert werden. Die Bezeichnung Redoxreaktion (Kurzfassung für Reduktion-Oxidation) steht für Reaktionen, in deren Verlauf sich die Oxidationszahl von Atomen ändert.Substanzen, die andere Substanzen reduzieren können, wirken reduzierend und werden als Reduktionsmittel, Reduktans oder Reduktor bezeichnet. Andererseits wirken Substanzen, die andere Substanzen oxidieren, oxidierend und werden als Oxidationsmittel, Oxidans oder Oxidator bezeichnet. Reduktionsmittel übertragen Elektronen auf eine andere Substanz, womit sie selbst oxidiert werden. Umgekehrt entfernen Oxidationsmittel Elektronen von anderen Substanzen, womit sie selbst reduziert werden. Reduktionsmittel werden als Elektronendonator (lat.: donare = schenken, geben) oder Elektronenspender bezeichnet, weil sie Elektronen "abgeben". Entsprechend nennt man Oxidationsmittel auch Elektronenakzeptor (lat.: acceptare = empfangen) oder Elektronenempfänger, weil sie im Verlauf der Reaktion Elektronen "empfangen". Die Summe der im Verlauf einer Redoxreaktion empfangenen beziehungsweise abgegebenen Elektronen ist Null - es werden keine Elektronen erzeugt oder vernichtet. Beispiele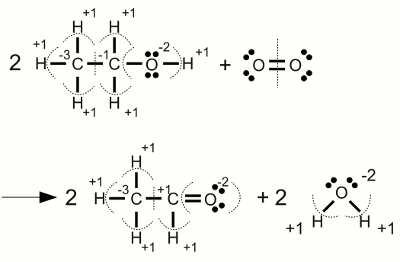 Oxidation von Ethanol (Alkohol) zu Acetaldehyd:
Oxidation von Ethanol (Alkohol) zu Acetaldehyd:Die Oxidationsstufen der beiden Kohlenstoffatome eines Ethanolmoleküls sind unterschiedlich. Im Verlauf der Reaktion mit molekularem Sauerstoff ändert das rechte Kohlenstoffatom seine Oxidationsstufe von -1 nach +1, womit es (virtuell) zwei Elektronen verliert. Die Oxidationsstufe von elementarem Sauerstoff ist Null. Während der Reaktion zu Wasser mit zwei Wasserstoffatomen des Ethanols, empfängt jedes der Sauerstoffatome zwei Elektronen und ändert seine Oxidationszahl auf -2. Wenn wir uns die stöchiometrischen Werte betrachten, sehen wir, dass aus zwei Ethanolmolekülen auf der linken Seite, zwei Acetaldehymoleküle auf der rechten Seite entstehen, wobei in jedem der beiden Ethanolmoleküle ein Kohlenstoffatom zwei Elektronen abgibt. Umgekehrt reagiert ein Sauerstoffmolekül, bestehend aus zwei Sauerstoffatomen, zu zwei Wassermolekülen wobei jedes Sauerstoffatom zwei Elektronen erhält. Der Sauerstoff wirkt als Oxidationsmittel und wird selbst reduziert. Umgekehrt wirkt Ethanol als Reduktionsmittel und wird selbst oxidiert. 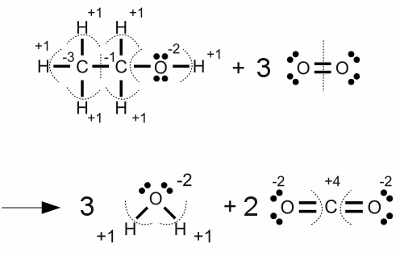 Verbrennung von Alkohol:
Verbrennung von Alkohol:Bei der vollständigen Verbrennung von Ethanol entsteht Wasser und Kohlendioxid. Im Verlauf dieser Reaktion ändert sich die Oxidationszahl der Kohlenstoffatome von -3 beziehungsweise -1 auf +4 (dem höchstmöglichen Wert für Kohlenstoff). Die Oxidationsstufe des beteiligten elementaren Sauerstoffs ändert sich von Null auf -2. <<< Reaktionsgleichungen Elektrolyse >>> Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Archiv Download Reaktionen Spiele Verweise Gadgets Kontakt Impressum |
|
|